Arbeitsgruppe im Portrait: Umwelttoxikologische Risikoabschätzung
und humane Sphärenmodelle am
Leibniz-Institut für Umweltmedizinische Forschung (IUF) der
Heinrich-Heine-Universität Düsseldorf
Das Leibniz-Institut für Umweltmedizinische Forschung (IUF) ist seit 2011 Mitglied der Leibniz-Gemeinschaft. Es erforscht umweltinduzierte Erkrankungen, insbesondere biologische Wirkungen von Umweltschadstoffen auf den menschlichen Organismus, überwiegend auf die Haut, die Lunge und das Gehirn, aber auch andere Organe. Das Institut gliedert sich u. a. in zwei Forschungsabteilungen, in die Umwelt-induzierten Alterungsprozesse und die Umwelt-induzierten Störungen des Immunsystems / Immuntoxikologie. Die Arbeitsgruppe von Prof. Ellen Fritsche heißt genau genommen „Umwelttoxikologische Risikoabschätzung und humane Sphärenmodelle“.
Prof. Dr. med. Ellen Fritsche ist Leiterin der Arbeitsgruppe (AG) „Umwelttoxikologische Risikoabschätzung und humane Sphärenmodelle“ am Leibniz-Institut für umweltmedizinische Forschung (IUF) an der Heinrich-Heine-Universität Düsseldorf.

Arbeitsgruppe Umwelttoxikologische Risikoabschätzung und humane Sphärenmodelle des Leibniz-Instituts für Umweltmedizinische Forschung Düsseldorf. letzte Reihe dritte von links: Leiterin Prof. Ellen Fritsche.
Foto: IUF
Ihre Spezialgebiete fokussieren sich seit dem Jahr 2002 auf die Entwicklungsneurotoxikologie1 und die Dermatotoxikologie. Im Zentrum ihrer in vitro-Forschungen stehen zum einen Verfahren zum Ersatz und zur Ergänzung von Tierversuchen, zum anderen die Erforschung der molekularen Mechanismen adverser2 Effekte von Umweltnoxen3 auf menschliche Zellen.
Bei der Forschung an Ergänzungs- und Ersatzmethoden zum Tierversuch wird insbesondere der Mechanismus relevanter Stoffwechsel-Signalwege in der Reaktion auf eine potenziell schädliche Substanz identifiziert und analysiert. Diese Stoffwechselsignalwege nennt man englisch „Adverse Outcome Pathways“ (AOPs). Besonders wichtig ist dabei, die Spezies-spezifischen Unterschiede (zwischen Mensch und Tier) in diesen Stoffwechselsignalwegen herauszufinden. Da ein Ersatz von Tierversuchen technisch noch nicht realisierbar ist, soll diese Analyse Spezies-spezifischer Signalwegsunterschiede helfen, die Ergebnisse des Tierversuchs auf den Menschen zu extrapolieren4 und somit der Verbesserung der Risikoabschätzung für den Menschen dienen.
Die Signalwege, die in der Arbeitsgruppe von Prof. Fritsche derzeit untersucht werden, beinhalten den Arylhydrokarbonrezeptor5, den Östrogenrezeptor6, den Schilddrüsenhormonrezeptor7 sowie den Transkriptionsfaktor Nrf28. Dabei werden mit den molekularen Endpunkten9 soweit wie möglich immer funktionelle, zellbiologische Endpunkte korreliert. Dies geschieht in der Regel in dreidimensionalen (3D) Zellmodellen, die aus Primärzellen10 bestehen.
Doktorandin Jenny Baumann kultiviert Neurosphären im Inkubator.
Foto: IUF.
Arylhydrocarbon-Rezeptor (AhR)
Der Arylhydrocarbon-Rezeptor ist ein Protein. Im Cytosol liegt es aber als Proteinkomplex mit weiteren Proteinen vor (1). Bei Kontakt mit einer körperfremden Substanz (Xenobiotikum) wird diese gebunden, der AhR wandert in den Zellkern und bindet an eine bestimmte Stelle der DNA-Sequenz, wodurch die Produktion eines Proteins des entsprechenden Genabschnitts eingeleitet wird. Es werden Gene abgelesen, die für Proteine mit oxidierenden und reduzierenden Eigenschaften von Fremdstoffen (aus der Cytochrome P450-Familie) kodieren. Hier sind vor allem CYP1A1 und CYP1B1 zu nennen. Die Proteine sorgen dann zunächst einmal für einen Umbau der körperfremden Substanz, indem ein Sauerstoffatom (2) eingebaut wird. Der AhR ist also eine Art Trigger für diesen Prozess. Aber noch weitere an diesem Prozess beteiligte Stoffwechselenzyme stehen unter Einfluss des AhR. Der AhR ist nicht spezialisiert, sondern wird bei vielen verschiedenen Xenobiotika aktiv. CYP1A1 vermittelt wesentlich die Aktivierung von polyaromatischen Kohlenwasserstoffen zu Mutagenen. Daneben ist CYP1A1 auch am Metabolismus von Estradiol zu 2-Hydroxyestradiol beteiligt, wobei die Metaboliten von Estradiol im Verdacht stehen, kanzerogen zu wirken (3). CYP1B1 hat eine ähnliche Funktion: es ist das Schlüsselenzym bei der metabolischen Aktivierung von toxischen Umweltstoffen (z. B. polyzyklische aromatische Kohlenwasserstoffe wie Benzo[a]pyren) und körpereigenen Substanzen wie estrogene Hormone zu ultimativ kanzerogenen Metaboliten (4).
Jenny Baumann überwacht die automatische Herstellung von Verdünnungsreihen für die Chemikalientestungen.
Foto: IUF.
Östrogenrezeptor
Östrogenrezeptoren (oder Estrogenrezeptoren) sind Steroidrezeptoren, die durch das weibliche Sexualhormon Östrogen aktiviert werden. Estrogenrezeptoren bilden, wenn sie ein Östrogen gebunden haben, zusammen mit einem weiteren Estrogenrezeptor einen sogenannten Dimerkomplex und wandern dann in den Zellkern zur DNA, wo eine bestimmte Region des genetischen Materials abgelesen wird (5). Bei Säugern haben die Steroidhormone eine Vielzahl unterschiedlicher Funktionen. Sie regulieren die Differenzierung, Proliferation (Wachstum und Zellteilung), Apoptose (programmierter Zelltod) und Funktion einer großen Zahl unterschiedlicher Zelltypen. Vermutlich wird fast jeder Gewebetypus durch mindestens eines der verschiedenen Steroidhormone beeinflußt (6).
Ein wichtiger Zusammenhang ist der Schutz vor Hautalterungsprozess durch UV-Strahlung: Östrogen ist in der Lage, einen Wachstumsfaktor aus den Keratinozyten der Haut freizusetzen und damit die Menge von Hyaloronsäure und Versikan V2 (ein hyaloron-bindendes Proteoglykan) zu erhöhen, was die Zellteilung (Proliferation) unterstützt und Entzündungsprozessen entgegenwirkt (7). Hyaluronsäure besitzt die Fähigkeit, relativ zu ihrer Masse sehr große Mengen an Wasser zu binden, vor allem im Bindegewebe.
Neurosphären (siehe Kasten, hier blau) und beginnende Differenzierung in Nervenzellen und deren Wanderung (Ausschnitt links unten). Zu erkennen sind Zellkörper in blauem DAPI-Fluoreszenzfarbstoff und die Nervenfortsätze (Axone) in grün/gelb (Beta(III)Tubulin Antikörper mit einem an grüne Fluoreszenz gekoppelt).
Foto: IUF.
Neurosphären und NHNP-Zellen
Vergleichbar den embryonalen Stammzellen können sich neurale Stammzellen selbst erneuern und sind unbeschränkt lebensfähig. Sie unterscheiden sich jedoch von den embryonalen Stammzellen hinsichtlich ihres Differenzierungspotenzials, da sie sich lediglich in die drei dominanten Zelltypen des Gehirns entwickeln können, in Astrozyten, Oligodendrozyten und Neuronen. Neurale Stammzellen können in Form von Einzelzellsuspensionen und auch in dreidimensionalen Zellaggregaten, sogenannten Neurosphären, kultiviert werden (8). In vitro gezüchtet bilden sie eine Kugelform (Neurosphären). Sie simulieren den Prozess der Gehirnentwicklung (9).
Unter NHNP-Zellen versteht man „normale humane neurale Progenitorzellen“, die als Neurosphären kultiviert werden. Da sich Firmen auf ihre Züchtung spezialisiert haben, können sie käuflich erworben werden und zu Testzwecken, z. B. zur Untersuchung von Substanzen auf entwicklungsneurotoxische Einflüsse, genutzt werden. In der Arbeitsgruppe wurde solch ein dreidimensionales Zellsystem aus humanen neuronalen Vorläuferzellen entwickelt. Mit diesem Verfahren lassen sich kosmetische Stoffe, Arzneimittel oder Chemikalien auf ihre Beeinträchtigung von Nervenzellen testen.
M. Sc. Martin Schmuck misst die Anzahl differenzierter Neurone aus Neurosphären sowie Neuritenlängen.
Foto: IUF.
Dreidimensionale Primärzellsysteme spiegeln den Metabolismus am besten
Die Wahl des Zellsystems ist ein zentrales Thema der Arbeitsgruppe, da sich zum einen die Primärzelle durch ihr molekulares Programm von der immortalisierten11 oder der Tumorzelle unterscheidet, zum anderen Zellen im 3D-Verband andere Signaltransduktionswege12 beschreiten als in 2D komplett auf Plastik wachsende Zellen. Dieses Thema hat die Gruppe auch in Bezug auf den für die Toxikologie zentralen Punkt des Fremdstoffmetabolismus aufgegriffen. Sie hat dabei gezeigt, dass 3D-Zellsysteme aus Primärzellen den Metabolismus des Ursprungsorgans am authentischsten wiedergeben. Zusammenfassend gesagt untersucht die Arbeitsgruppe von Prof. Fritsche Signalweg-spezifische Störungen zellulärer Funktionen durch Umweltnoxen in humanen sowie in 3D-Modellen des Nagers. Solche Systeme sollen genutzt werden, um das Gefährdungspotenzial oder auch den protektiven Effekt von Substanzen auf das sich entwickelnde Nervensystem sowie die Haut zu erfassen.
Schilddrüsenhormonrezeptor
Astrozyten, ein Zelltyp der grauen und weißen Substanz des Gehirns, haben eine wichtige Funktion bei der Ernährung von Nervenzellen durch ihren Kontakt zu den Blutgefäßen. Sie transportieren z. B. das Schilddrüsen-hormon über die Schilddrüsenrezeptoren in das Nervengewebe (10). Schilddrüsenhormon ist bei Wachstum, Entwicklung und Funktion des Zentralnervensystems beteiligt (11). Das von der Schilddrüse produzierte Hormon 3,3´,5-Trijodthyronin (T3) beeinflusst sowohl den Differenzierungs- als auch den Reifeprozess von Nervenzellen (11). Unter T3-Einfluss in vitro beenden Vorläuferzellen die Zellteilung und beginnen sich zu differenzieren. Das Hormon fördert zudem die Ausreifung der Zellen und das Längenwachstum der Zellfortsätze und deren Verzweigung. Funktionsstörungen der Schilddrüse haben deutlichen Einfluss auf die Entwicklung der weißen Substanz im Zentralnervensystem. Die Wirkung von T3 wird durch die Bindung des Hormons an seinen Rezeptor (TR) vermittelt. Der TR fungiert nach der Bindung des Liganden (Hormons) als Transkriptionsfaktor, indem er an eine regulatorisch wirkende DNA-Sequenz bindet und dadurch die Genexpression reguliert (12).
Polychlorierte Biphenyle (PCBs) beeinflussen die Entwicklung des Gehirns. Mit dem NHNP- Neurosphärenmodell der Arbeitsgruppe von Prof. Fritsche lassen sich diese Vorgänge genauestens studieren. Da sich die Vorläuferzellen in Astrozyten, Oligodendrozyten und Neurozyten entwickeln können, kann nicht nur der Fremstoffmetabolismus gezeigt werden, sondern auch der Signaltransduktionsweg des Schilddrüsenhormons. In Versuchen konnte z. B. gezeigt werden, dass PCBs den Stoffwechsel-Signalweg des Schilddrüsenhormons benutzen bzw. Schilddrüsenhormon-ähnliche Effekte zeigen (13).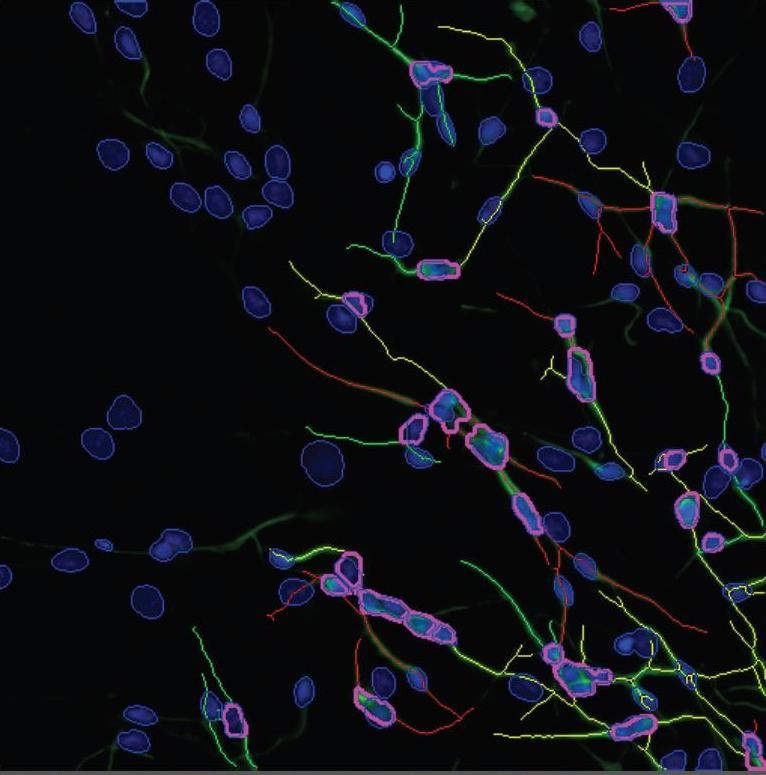
NHNP Zellen (normale humane neurale Progenitorzellen) differenzieren in Neurozyten, Astrozyten und Oligodendrozyten. Zu sehen sind Neurozyten (mit dem Marker ß(III)Tubulin grün gefärbt) und Astrozyten (mit dem Marker GFAP rot gefärbt).
Foto: IUF.
Transkriptionsfaktor Nrf2
Der Transkriptionsfaktor Nrf2 (nuclear factor-erythroid 2-related factor 2) ist verantwortlich für die Hochregula-tion der durch das Antioxidans-Response-Element (ARE) vermittelten Genexpression. Enzyme und Proteine, die mit diesem Nrf2/ARE-Signalweg exprimiert werden, besitzen chemisch vielfältige zellschützende Eigenschaften und bilden eine Verteidigung gegen toxische Metabolite und Xenobiotika (14).
Der Arylhydrokarbonrezeptor (AhR) ist ein Transkriptionsfaktor und bindet an Fremdstoffe wie z. B. Dioxine. Hiernach wandert er vom Cytosol in den Zellkern und bindet an eine bestimmte Stelle der DNA. Der Genabschnitt, der dann abgelesen und in ein Protein umgesetzt wird, kodiert für Enzyme der Phase I und II (siehe Kasten AhR). Viele der Phase-II-Enzyme werden ko-reguliert mit Hilfe des Transkriptionsfaktors Nrf2, dem Hauptregulator der antioxidativen Zellantwort. Die beiden Transkriptionsfaktoren kooperieren daher in der Stressantwort gegen potenziell schädliche Substanzen. Die anti-endzündliche Rolle des Ah-Rezeptors in der Haut ist auf dessen Aktivierung des zellschützenden Nrf2-Systems zurück zu führen (15).
„...Wir wollen die molekularen Speziesunterschiede verstehen...“
InVitroJobs befragte Prof. Dr. med. Ellen Fritsche zu den gegenwärtigen Entwicklungen Ihrer Forschung und zu einem zukünftigen Ausblick.
InVitroJobs: Wie viele Mitarbeiter arbeiten in Ihrer Arbeitsgruppe in Düsseldorf?
Prof. Dr. med. Ellen Fritsche: Wir haben 11 feste Mitarbeiter und jährlich wechselnd ein bis zwei Masterstudenten.
InVitroJobs: An welcher Fragestellung arbeiten Sie gerade? Wie ist der gegenwärtige Entwicklungsstand?
Prof. Dr. med. Ellen Fritsche: Momentan beschäftigen wir uns zum einen mit der molekularen Charakterisierung von Speziesunterschieden, d. h. mit der quantitativen Erfassung von Signalwegen, die zu zellulären Funktionsveränderungen führen. Zum anderen haben wir begonnen, reprogrammierte Zellen des Menschen zu generieren, aus denen in unbeschränkter Menge ohne ethische Bedenken verschiedene Zelltypen differenziert werden können. Arbeiten mit solchen induzierten pluripotenten Stammzellen (iPS Zellen)13 werden meiner Meinung nach die Grundlage der Toxikologie des 21. Jahrhunderts sein.
InVitroJobs: Können Tierversuche damit reduziert oder ersetzt werden, wenn ja: welche?
Prof. Dr. med. Ellen Fritsche: Da derzeit für die Regulation von Chemikalien im Bereich der (Entwicklungs)neurotoxizitätstestung alternative Methoden nicht akzeptiert sind, könnte man momentan unsere Tests zum Beispiel für ein frühes In-House Pre-screening14 nutzen. Dies würde die Zahl der Tierversuche reduzieren. Im Falle der Akzeptanz von wissenschaftlich soliden in vitro15 Verfahren für regulatorische Zwecke in der Zukunft betreffen unsere Arbeiten die OECD Guideline 42616 für Entwicklungsneurotoxizität bzw. einen Teil der Extended One-Generation Reproductive Toxicity Study17 (OECD TG 443).
InVitroJobs: Ist die Methode derzeit im Optimierungsprozess, in der Prä-Validierung18 oder in der Validierung19?
Prof. Dr. med. Ellen Fritsche: Die Methode ist derzeit in der Prä-Validierung, Gelder für eine Validierung sind beantragt.
InVitroJobs: Kann man Ihre Forschungsergebnisse auch in der Grundlagenforschung einsetzen?
Prof. Dr. med. Ellen Fritsche: Ich denke, dass unsere Arbeiten auch für die Grundlagenforschung essenziell sind, und zwar aus zwei Gründen: Zum einen ist gerade in der Grundlagenforschung die Nähe des benutzten in vitro-Systems zur in vivo-Situation sehr wichtig, um die richtigen Schlüsse aus den Arbeiten zu ziehen. Eine Tumorzelle reagiert in vielen Aspekten nun einmal anders auf einen exogenen Stimulus als eine ‚normale’, nicht transformierte Zelle. Zum anderen ist auch der translationale Aspekt, nämlich die Extrapolation von Tierdaten auf den Menschen über korrespondierende in vitro-Systeme von Mensch und Nager (gemäß des Parallelogrammansatzes; Erklärung siehe weiter unten im Interview) für die Grundlagenforschung äußerst wichtig. Dieser Ansatz hilft z. B., die Bedeutung von Ergebnissen aus transgenen Tieren für den Menschen zu verstehen. Zudem eignen sich solche Primärzellsysteme auch, um gewisse Arbeiten in transgenen Tieren zu ersetzen, indem man Gene mittels viraler Transduktion20 auch in 3D-Systemen herunterknockt21 oder überexprimiert22. Diese Techniken hat meine Arbeitsgruppe etabliert, und wir nutzen sie nun regelmäßig auch für Grundlagen-orientierte Fragestellungen.
InVitroJobs: Ich kann mir vorstellen, dass der Andrang von Nachwuchswissenschaftlern, bei Ihnen zu arbeiten, recht groß ist.
Prof. Dr. med. Ellen Fritsche: Das ist tatsächlich so und freut mich sehr. Gerade diese Woche habe ich erfahren, dass ein talentierter Nachwuchswissen-schaftler aus Korea die Zusage für ein hochkompetitives Leibniz-DAAD Postdoc-Stipendium bekommen hat und ab Anfang nächsten Jahres in unserer Arbeitsgruppe arbeiten wird. Dies ist schon das zweite Mal in Folge, dass sich einer dieser Stipendiaten für meine Arbeitsgruppe entschieden hat. Außerdem bewerben sich regelmäßig Studierende der Heinrich-Heine-Universität Düsseldorf bei mir, um ihre Abschlussarbeit in meiner Arbeitsgruppe anzufertigen.
InVitroJobs: Sie arbeiten schon seit 2001 an Ersatzverfahren zu Tierversuchen: Hat sich die Forschungsatmosphäre seitdem verbessert oder verschlechtert?
Prof. Dr. med. Ellen Fritsche: Die Atmosphäre hat sich gefühlt verbessert. Das liegt zum einen an der immer größer werdenden Datenlage, die dazu führt, dass der Weg zum Erfolg immer klarer definiert wird und sich Unsicherheiten verkleinern. Zum anderen tragen natürlich auch solche Mammutprojekte der USA wie ToxCast (16) und TT21C (17) dazu bei, dass sich die Stimmung in Europa im Hinblick auf alternative Testverfahren und moderne Konzepte zur Risikoabschätzung deutlich verbessert. In dieser Beziehung sind die USA ein absoluter Vorreiter.
InVitroJobs: Wie sind Ihre Erfahrungen mit den Unterschieden zwischen Mensch und Tier, vor allem auch in den Zellkulturen? Welche Erkenntnisse liegen denn zu den Funktionalitätsunterschieden von zellulären Signalwegen zwischen Tier und Mensch vor?
Prof. Dr. med. Ellen Fritsche: Die Erfahrungen meiner Arbeitsgruppe zeigen ganz klar, dass es Speziesunterschiede in zellulären Signalwegen zwischen Mensch und Tier gibt. Unsere Erfahrungen beschränken sich dabei auf Unterschiede in neuralen Vorläuferzellen zwischen Mensch und Maus oder Mensch und Ratte. Interessanterweise wurde gerade eine Ratte generiert, die keinen Arylhydrokarbonrezeptor (AhR) besitzt. Die entsprechende Maus gibt es schon seit vielen Jahren. Der klinische Phänotyp der AhR-KO-Ratte unterscheidet sich jedoch deutlich von dem der AhR-KO-Maus. Das bestätigen unsere Beobachtungen in vitro. Warum sollte der Mensch einem Nager ähnlicher sein als sich zwei verschiedene Nagetierspezies untereinander gleichen? Genau darauf basiert ja auch das TT21C-Konzept der Amerikaner: die menschliche Zelle als Testsubjekt zu benutzen. Wir gehen einen Schritt weiter und wollen die molekularen Speziesunterschiede verstehen, um mit diesen Informationen zusätzlich zum bisher leider unvermeidbaren Tierversuch die Risikoabschätzung für den Menschen zu verbessern. Sind für jeden Zelltyp die kritischen Signalwege einmal verstanden, so wird es möglich sein, gemeinsam mit den verschiedenen mathematischen Modellingmöglichkeiten (wie z. B. quantitative Struktur-Wirkungsbeziehung23, pharmakokinetisches Modelling24) mehr Tierversuche zu ersetzen.
InVitroJobs: Es werden doch noch vielfach Tiere in der Forschung eingesetzt. Wird den Funktionalitätsunterschieden zwischen Mensch und Tier nicht so eine Bedeutung beigemessen?
Prof. Dr. med. Ellen Fritsche: Das ist zwar tatsächlich in der Grundlagenforschung bekannt, aber die Effekte im Gesamtorganismus gegenüber der Zellkultur werden generell mit einer höheren Priorität behandelt als der Speziesunterschied Nager/Mensch. Es haben meiner Meinung nach jedoch beide ihre Wichtigkeit und somit Daseinsberechtigung.
InVitroJobs: Kann man sagen, dass der AhR-Signalweg so ein gesuchter „Pathway of Toxicity“25 ist?
Prof. Dr. med. Ellen Fritsche: Der AhR ist ein sehr ambivalentes Protein. Zum einen vermittelt er die Toxizitäten von polyzyklischen aromatischen Kohlenwasserstoffen, UVB-Strahlung und anderen Noxen und trägt somit z. B. zur Tumorentstehung der Haut bei. Auf der anderen Seite scheint er aber auch für viele Funktionen der Zellhomöostase26 verantwortlich zu sein, d. h. in gewisser Weise ist er auch am Schutz von Zellen beteiligt. Dies scheint eine Gemengelage aus Zelltyp, Art des Liganden und Dosis zu sein. Das macht die AhR-Forschung so kompliziert – und so reizvoll. Ja, aber insgesamt kann man den AhR-Signalweg als einen kritischen AOP (s. o.) bezeichnen. Daher ist die Erkenntnis, dass er im fetalen Gehirn des Menschen so gut wie gar nicht exprimiert und auch nicht funktionell ist, von großer Bedeutung. Dies vor allem im Hinblick auf seine Expression und Funktionalität im fetalen Nagergehirn. Ich werde immer wieder nach der Bedeutung der fehlenden AhR-Expression im fetalen Gehirn des Menschen gefragt. Meine Vermutung dazu lautet, dass durch das Fehlen dieses Rezeptors das sich entwickelnde humane Gehirn vor PAH-induziertem oxidativem Stress geschützt ist und sich somit ungestörter entwickeln kann.
InVitroJobs: Auch wenn das Thema unüberschaubar und kompliziert ist: Lässt sich in wenigen einfachen Sätzen erklären, was das Problem in der Entwicklung geeigneter Ersatzverfahren in der Toxizität ist, um den Tierversuch abzulösen?
Prof. Dr. med. Ellen Fritsche: Die Problematik ist natürlich vielschichtig, aber ich versuche sie auf die wichtigsten Punkte zu reduzieren. Das grundlegende Problem ist die in vitro-/in vivo-Extrapolation. Was bedeuten meine in vitro-Ergebnisse für den Gesamtorganismus in vivo? Zum einen gibt es das kinetische Problem, nämlich die Schwierigkeit in der Abschätzung der internen (intrazellulären) Dosis in vitro versus der Organdosis in vivo. Zum anderen stellt sich die Frage des in vitro-Endpunkts. Ist Zytotoxizität ein wesentlicher Marker? Oder sind Genexpressionsveränderungen Marker mit guter Vorhersagbarkeit von Toxizitäten? Wenn ja, wie grenzt man adaptive gegen adverse Veränderungen ab? Da ist es meiner Meinung nach hilfreich, nach funktionellen Parametern zu entscheiden, und zwar zelltypspezifisch. Des Weiteren muss ein in vitro-Test gegen das adäquate in vivo-Korrelat validiert werden. Oftmals sind Daten vom Menschen rar, so dass man auf bereits existente Tierversuche zurückgreifen muss. In Anbetracht der bereits diskutierten Speziesunterschiede ist es jedoch nicht sinnvoll, ein humanes in vitro-System gegen einen Tierversuch zu validieren. Daher müsste eigentlich als ‚Proof-of-Concept’27 das entsprechende in vitro-Modell des Tiers gegen den Tierversuch validiert werden (zur Akzeptanz des in vitro-Tests), um dann Speziesunterschiede zwischen Tier und Mensch in vitro erfassen zu können. Diesen „Parallelogrammansatz“ verfolgt meine Arbeitsgruppe und wird langfristig hoffentlich die Akzeptanz von Ersatzmethoden verbessern.
InVitroJobs: Wie weit ist es denn mit der Entwicklung geeigneter Hautsensibilisierungstests? Lässt sich absehen, wann es zu einer Anerkennung geeigneter Ersatzverfahren in dem Endpunkt „Hautsensibilisierung“ kommt?
Prof. Dr. med. Ellen Fritsche: Da habe ich kürzlich sehr vielversprechende Daten eines großen deutschen Unternehmens gesehen, und ich bin zuversichtlich, dass sich auf diesem Gebiet in nächster Zeit die Anerkennung solcher Verfahren durchsetzen wird.
InVitroJobs: Was wünschen Sie sich für die Zukunft?
Prof. Dr. med. Ellen Fritsche: Ich wünsche mir genügend Fördermittel, um mit den Neurosphären als Beispiel in einem Proof-of-Concept zu zeigen, dass sich mit dem klassischen Parallelogrammansatz 3D-Kulturen vom Nager und vom Menschen unter Einbeziehung von AOPs dazu eignen, Toxizitäten zuverlässig vorherzusagen.
InVitroJobs: Wir danken für das Gespräch.
Glossar:
1 Entwicklungsneurotoxikologie: sie befasst sich mit den funktionellen und morphologischen Effekten exogener Substanzen auf das sich entwickelnde Nervensystem, die durch eine Exposition während der Schwangerschaft oder der Neugeborenenperiode zu pathologischen Gehirnveränderungen führen.
2 advers: schädlich
3 Umweltnoxen: (med.) Stoff oder Umstand, der schädigende, (d. h. krankheitserzeugende) Wirkung auf einen Organismus oder auf ein Körperorgan ausübt.
4 Extrapolation: ein statistischer Annäherungsprozess, aus erhobenen Daten werden Rückschlüsse auf eine Entwicklung gezogen. Die gezogenen Schlüsse sind nicht vollständig abgesichert (http://de.statista.com/statistik/lexikon/definition/54/extrapolation/)
5 Arylhydrocarbon-Rezeptor (AhR): Der Arylhydrocarbon-Rezeptor ist ein Protein (siehe Kasten im Text).
6 Östrogenrezeptor: ist ein Steroidrezeptor, der durch das Hormon Östrogen aktiviert wird und dann einerseits an der DNA als Transkriptionsfaktor dient, d. h. dafür sorgt, dass ein bestimmter Genabschnitt an der DNA abgelesen und infolgedessen in ein Protein umgesetzt wird (siehe Kasten) (http://de.wikipedia.org/w/index.php?title=Spezial:Buch&bookcmd=download&collection_id=78ec56fd0717c5f9&writer=rl&return_to=Estrogenrezeptor)
7 Schilddrüsenhormonrezeptor: Das von der Schilddrüse produzierte Hormon 3,3´,5-Trijodthyronin (T3) beeinflusst sowohl den Differenzierungs- als auch den Reifeprozess von Nervenzellen. Unter T3-Einfluss in vitro beenden Vorläuferzellen die Zellteilung und beginnen sich zu differenzieren. Die Wirkung von T3 wird durch die Bindung des Hormons an seinen Rezeptor (TR) vermittelt (siehe Kasten im Text).
8 Transkriptionsfaktor Nrf2: Der Transkriptionsfaktor Nrf2 ist verantwortlich für die Hochregulation der durch das Antioxidans-Response-Element (ARE) vermittelten Genexpression (siehe Kasten).
9 Endpunkt: Studienziel.
10 Primärzellen: Primärkulturen werden unmittelbar nach der Zell- oder Gewebeentnahme angelegt. Sie sind meist nicht unbegrenzt teilungsfähig.
11 immortalisierte Zellen: Zelllinien sind Zellen einer Gewebeart, die sich in Kultur unbegrenzt fortpflanzen können. Mit Hilfe gentechnischer Methoden kann man die Zellen unbegrenzt teilungsfähig machen (immortalisieren). Gewebe-Sphäroide: dreidimensionale Gewebekügelchen, das chemische Milieu und die Zell-Zell-Kontakte sind anders als bei flachen Schichten.
12 Signaltransduktionsweg (Signalübertragungsweg): ein Prozess, durch den Zellen auf äußere Reize reagieren, diese umwandeln und in das Zellinnere weiterleiten. Hierbei sind oft eine Vielzahl von Enzymen und sekundären Botenstoffen beteiligt (http://de.wikipedia.org/wiki/Signaltransduktion).
13 iPS oder induzierte pluripotente Stammzellen: Es sind pluripotente Stammzellen, die durch künstliche Reprogrammierung von ausdifferenzierten Zellen entstanden sind. Die Umwandlung wird von außen angeregt. Hierfür nutzt man sogenannte Transkriptionsfaktoren (Proteine, die an bestimmte Stellen der DNA binden und bei der Transkription, also der Umsetzung der genetischen Information in ein Protein eine Rolle spielen, siehe Proteinbiosynthese), um bestimmte Gene in den Zellen einzuschalten. iPS-Zellen ähneln natürlichen Stammzellen in vielen Eigenschaften stark.
14 Screening-Studien: Screening ist ein auf bestimmte Kriterien ausgerichteter Siebtest. Eine Screeningstudie ermöglicht es z. B. Ärzten und Pharmaunternehmen die am besten geeignete Methode zur Erkennung von bestimmten Krankheiten oder Gesundheitszuständen zu identifizieren.
15 In vitro-Methoden: übersetzt etwa „im Reagenzglas“, Versuche oder Messungen, die an entnommenem lebenden Gewebe außerhalb eines lebenden Organismus in einer künstlichen Umwelt, z. B. Petrischale, stattfinden. Im Gegensatz dazu „in vivo“: „im Lebenden“, mit in vivo-Verfahren sind Verfahren und Experimente am lebenden Tier gemeint.
16 OECD Guideline 426: Europäische Vorschrift über die Vorgehensweise bei der Untersuchung der Wirkung von Substanzen auf die Entwicklungsneurotixizität. Das zu bevorzugende Tier ist die Ratte. Schwangeren Tieren wird die Substanz verabreicht und die Nachkommen auf Entwicklungsschäden hin untersucht. Die Testguideline ist im Hinblick auf die Speziesunterschiede zwischen Mensch und Ratte nicht unumstritten (18, 19).
17 Extended one-generation-study (OECD Testguideline 443): Die Organisation für Wirtschaftliche Zusammenarbeit und Entwicklung (OECD) in Paris hat 2011 eine Richtlinie zur Prüfung von Chemikalien auf mögliche Entwicklungsschäden anerkannt. Auf Basis der „Extended One Generation Reproductive Toxicity Study“ kann die Zahl der verwendeten Tiere im Vergleich zum bisher angewandten Test um knapp die Hälfte reduziert werden. Denn die belastenden Tierversuche müssen nicht mehr an der zweiten Generation der Tiere durchgeführt werden, weil nachgewiesen ist, dass die Verwendung einer zweiten Generation keine zusätzlichen Erkenntnisse liefert (20).
18 Prä-Validierungsstudie: Verbundstudie unter Beteiligung mehrerer unabhängiger Prüflabore mit dem Ziel festzustellen, ob die Methode zuverlässig und reproduzierbar ist.
19 Validierung: Durch die Validierung wird der dokumentierte Beweis erbracht, dass ein Prozess oder ein System die vorher spezifizierten Anforderungen (Akzeptanzkriterien) reproduzierbar im praktischen Einsatz erfüllt (http://de.wikipedia.org/wiki/Validierung_%28Pharmatechnik%29)
20 Virale Transduktion: Mit Hilfe von Viruspartikeln wird gezielt genetisches Material in lebende Zellen eingeschleust. Den Transport von DNA in eine Zelle mit Hilfe eines Virus nennt man Transduktion. (http://de.wikipedia.org/wiki/Viraler_Vektor)
21 Herunter „knocken“: hierin ist der Begriff „knock-down“: Durch gezielten Einbau genetischen Fremdmaterials mit Hilfe von Viren kann erreicht werden, dass sich die neue Gensequenz mitten in eine Ursprungsgensequenz setzt, so dass dieses Gen nicht mehr abgelesen und in ein Protein übersetzt werden kann.
22 Überexprimierung: Hier wird ein bestimmtes Gen infolge gentechnischer Methoden besonders stark in der Zelle in ein Protein übersetzt.
23 Quantitative Struktur-Wirkungsbeziehung: quantitative Beziehung zwischen einer pharmakologischen, chemischen, biologischen, physikalischen Wirkung eines Moleküls mit seiner chemischen Struktur (http://de.wikipedia.org/wiki/Quantitative_Struktur-Wirkungs-Beziehung).
24 Pharmakokinetisches Modelling: Die Pharmakokinetik beschreibt die Gesamtheit aller Prozesse, denen ein Arzneistoff im Körper unterliegt. Dazu gehören die Aufnahme des Arzneistoffes (Resorption), die Verteilung im Körper (Distribution), der biochemische Um- und Abbau (Metabolisierung) sowie die Ausscheidung (Exkretion). Ist zusätzlich vor der Resorption die Freisetzung (Liberation) des Arzneistoffes aus der Arzneiform von Bedeutung (http://de.wikipedia.org/wiki/Pharmakokinetik). Mit der Gesamtheit aller verfügbaren Informationen soll am Ende ein Modell über den Stoffwechselablauf zur Vorhersage und Risikoeinschätzung von Substanzen entwickelt werden.
25 Pathway of Toxicity (PoT): in etwa Giftigkeits-Stoffwechselweg.
26 Zellhomöostase: Physiologisches Streben nach einem Gleichgewicht in der Zelle.
27 Proof-of-Concept: Begriff aus dem Projektmanagement, ein Meilenstein (Zwischenziel), an dem die Machbarkeit einer Studie z. B. belegt ist (http://de.wikipedia.org/wiki/Proof_of_Concept).
Literaturquellen:
(1) Jux, B. (2008): Die Bedeutung des Arylhydrocarbon Rezeptors für die Reifung und Funktion epidermaler Langerhans-Zellen in der Maus, Dissertation, Düsseldorf.
(2) http://de.wikipedia.org/wiki/Cytochrom_P450
(3) http://www.pharmagenomics.de/index.php/produkte/realtime-pcr-kits/cytochrome-p450/cyp1a1
(4) http://www.charite.de/forschungsberichte/FOB_2003-2005/deutsch/PJ/PJ15051.html
(5) http://de.wikipedia.org/wiki/Estrogenrezeptor
(6) Flötotto, T. (2001): Untersuchung alternativer Mechanismen der Genregulation
durch Östrogenrezeptor-Isoformen. Dissertation, Heinrich-Heine-Universität, Düsseldorf. http://docserv.uni-duesseldorf.de/servlets/DerivateServlet/Derivate-2152/152.pdf
(7) Röck, K. Et al. (2012): Estradiol Protects Dermal Hyaloron/Versican Matrix during Photoaging by Release of Epidermal Growth Factor from Keratinocytes. J. Biol. Chem. 287 (24): 20056-69.
(8) Moors, M. (2007): Normale Humane Neurale Progenitorzellen als in vitro Modellsystem für entwicklungsneuro-toxikologische Untersuchungen: Molekulare und zellbiologische Charakterisierung. Inaugural-Dissertation Heinrich-Heine-Universität, Düsseldorf.
(9) Moors, M. et al. (2009): Human Neurospheres as Three-Dimensional Cellular Systems for Developmental Neurotoxicity Testing. Environmental Health Perspectives 117 (7): 1131-1138.
(10) Goncalves Trentin, A. (2006): Thyroid hormone and atsrocyte morphogenesis. Journal of Endocrinology 189: 189-197.
(11) König, S. & Moura Neto, V. (2002): Thyroid hormone actions on neural cells. Cell Mol Neurobiol. 22 (5-6): 517-544.
(12) Huber, K. (2005): Urspung, Entwicklung und Differenzierung von Oligodendrozyten. Dissertation Universität München. http://edoc.ub.uni-muenchen.de/4250/1/Huber_Katharina.pdf
(13) Fritsche, E., et al. (2005): Polychlorinated Biphenyls Disturb Differentiation of Normal Human Neural Progenitor Cells: Clue for Involvement of thyroid Hormone Receptors. Environmental Health Perspectives 113/7: 871-876.
(14) Deutsche Multiple Sklerose Gesellschaft (http://www.dmsg.de/multiple-sklerose-forum/index.php?w3pid=msforum&kategorie=forum&tnr=8&mnr=61487
(15) Haarmann-Stemmann, T., Abel, J., Fritsche, E. & Krutmann, J. (2012): The AhR-Nrf2 pathway in keratinocytes: on the road to chemoprevention? J Invest Dermatol. 132 (1): 7-9. doi: 10.1038/jid.2011.359).
(16) ToxCast: http://www.epa.gov/ncct/toxcast/
(17) Tox21c: Tocixity Testing in the 21st Century. A Vision and a Strategy. Commitee on Toxicity Testing ans Assessment of Environmental Agents, National Research Council of the National Academies. http://www.nap.edu/catalog.php?record_id=11970
(18) http://www.oecd.org/dataoecd/20/52/37622194.pdf
(19) http://forums.alttox.org/index.php?PHPSESSID=3ecff1a21780010e29032a5949b4e506&topic=97.msg151#msg151
(20) http://forums.alttox.org/index.php?topic=702.msg1094#msg1094




 Dr. rer. nat.
Dr. rer. nat. Menschen für Tierrechte - Tierversuchsgegner Rheinland-Pfalz e.V.
Menschen für Tierrechte - Tierversuchsgegner Rheinland-Pfalz e.V.