Arbeitsgruppe im Portrait:
Klinisches Forschungslabor Kinderherzchirurgie
des Universitätsklinikums Tübingen
Unser erster Beitrag sind die Arbeitsgruppen „Hämokompatibilität“ und „PyrogenTest“ der Abteilung Klinisches Forschungslabor Kinderherzchirurgie des Universitätsklinikums Tübingen. Die zwei Schwerpunkte der angewandten Forschung und Entwicklung inklusive von Dienstleistungen werden im Folgenden beschrieben.
1. Die Entwicklung und Prüfung von blutkontaktierenden Implantaten auf Hämokompatibilität (Blutverträglichkeit)
Implantierbare Medizinprodukte, die mit dem Blut(kreislauf) in Kontakt kommen, müssen auf ihre Verträglichkeit mit Komponenten des Blutes geprüft werden. Dies kann über in-vitro-Modelle realisiert werden, in denen die Wechselwirkung des Implantates mit dem Hämostase-* bzw. Immunsystem geprüft wird. In der ISO 10993, Teil 4, sind diese Prüfungen international reguliert.
2. Die Prüfung von medizinischen Produkten auf Pyrogenfreiheit
Der in-vitro-Pyrogentest PyroDetect wurde für die Prüfung auf Pyrogenfreiheit von injizierbaren Arzneimitteln als vollständiger Ersatz des Tierversuchs entwickelt. Statt Fieber im Säugetierorganismus wird die Fieberreaktion im Reagenzglas nachgestellt: Fiebersignalstoffe (endogene Fiebermoleküle) werden in vitro in Humanblut detektiert. Blutkontaktierende medizinische Produkte (Injektions-, Infusionslösungen oder Feststoffe (Implantate)) können hitzestabile Bakterienrestbestände (Pyrogene) tragen, die beim Menschen Fieber, Blutdruckabfall, Multiorganversagen oder gar den Tod herbeiführen können. Aus diesem Grund schreibt der Gesetzgeber weltweit die Prüfung auf Pyrogenfreiheit vor. Die Anwendungsperspektiven des PyroDetect-Verfahrens sind vielseitig. Es kann sowohl für die Pyrogendetektion direkt auf Oberflächen von Implantatmaterialien als auch zur Messung von Luftqualität genutzt werden. Der Leiter der Arbeitsgruppe Pyrogen-Test, Dr. med. Stefan Fennrich gab InVitroJobs ein Interview zu Situation und Perspektiven dieses Testsystems.
In-vitro-Pyrogentest-Arbeitsgruppe, von links nach rechts: Prof. Dr. Hans Peter Wendel, Deborah Lutz, Marcell Post, Ulrike Hennig und Dr. Stefan Fennrich
Foto: Jan Niederländer
Retrospektive
Ausgangspunkt für unser Interview ist die Entwicklung des sogenannten PyroDetect-Verfahrens, das als Monozyten-Aktivierungstest (MAT) im Jahr 2010 Einzug in die europäische Pharmakopöe (EP Prüfvorschrift 2.6.30) gehalten hat. Der Test kann den Verbrauch von rund 200.000 Kaninchen pro Jahr in Europa ersetzen, die durchschnittlich zum Test auf Pyrogene eingesetzt würden. Der MAT gemäß europäischem Arzneibuch ist eine vollwertige Alternative zum in-vivo-Test. Laut internationaler Rechtsvorgaben muss eine tierversuchsfreie Alternative aus ethischen Gründen vorrangig angewendet werden. Somit wird der Kaninchenversuch künftig vollständig ersetzt werden können. Zeitliche Verzögerungen entstehen, weil viele Anwender den MAT-Test im Hause zunächst etablieren müssen, für die Zulassung von medizinischen Produkten sind internationale Qualitätssicherungsstandards zu beachten. Inzwischen muss der Einsatz von Kaninchen zum Test auf Pyrogene vom Entwickler eines medizinischen Produkts gegenüber der Behörde sehr gut begründet werden. Wer heute in Deutschland die Durchführung eines in-vivo-Pyrogen-Tests bei der zuständigen Behörde anzeigt, muss mit dem Widerspruch der Behörde rechnen. Die endgültige Zulassung für die USA und Japan steht noch aus. Die amerikanische ICCVAM (Interagency Coordinating Committee on the Validation of Alternative Methods), die an der Validierung des MAT bereits beteiligt war, befürwortet die behördliche Zulassung.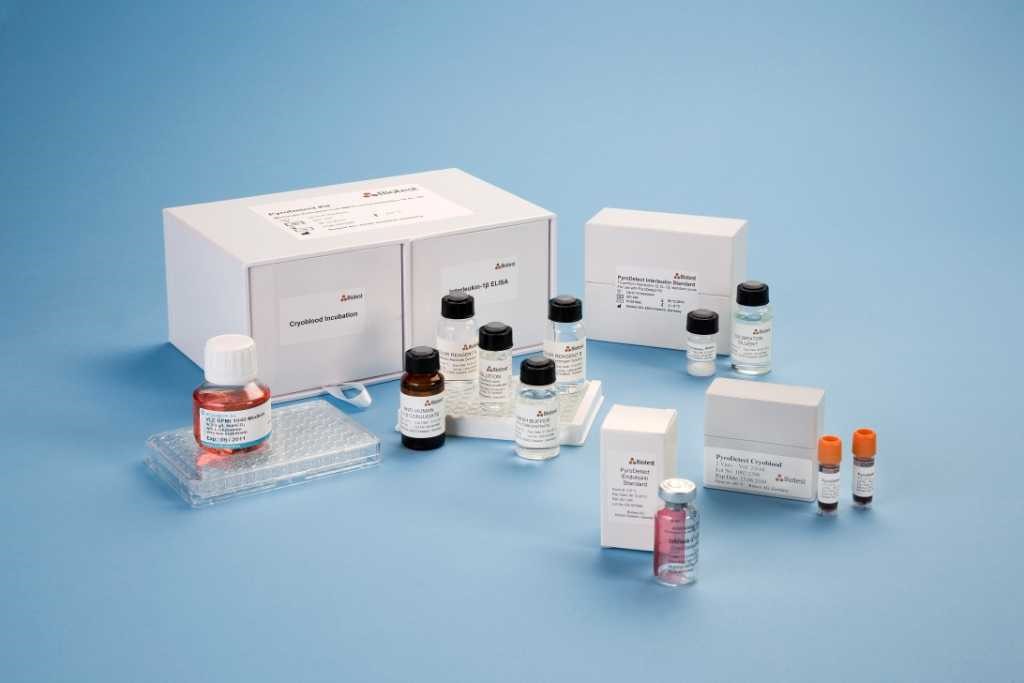
PyroDetect-Kit
Foto: Biotest AG
Entwickelt wurde der in-vitro-Pyrogentest ursprünglich von Prof. Dr. Albrecht Wendel, ehemaliger Inhaber des Lehrstuhls biochemische Pharmakologie an der Universität Konstanz, aktuell Direktor des Interfakultativen Zentrums für Pharmakogenomik und Arzneimittelforschung (IZEPHA, Universitätsklinik Tübingen), zusammen mit dem Toxikologen Professor Dr. Thomas Hartung, früherer Leiter von ECVAM, heutiger Inhaber des Doerenkamp-Zbinden-Lehrstuhls in Baltimore und Direktor des Center for Alternatives to Animal Testing (CAAT) der John Hopkins-Universität. Beide Wissenschaftler erhielten für ihre Entwicklung Auszeichnungen, u.a. den Europäischen Tierschutzpreis der Fédération Internationale pour la Substitution des Experiments Animaux 1994 und dem Internationalen Tierschutzpreis der Doerenkamp-Zbinden-Foundation 1996.
Mit im Arbeitsteam von Wendel und Hartung war Dr. Stefan Fennrich. Er leitete von 1997 bis 2005 die Entwicklungsgruppe „in-vitro Pyrogentest“ am Lehrstuhl von Prof. Dr. Albrecht Wendel in Konstanz. Dr. Fennrich arbeitet mit seiner eigenen Arbeitsgruppe inzwischen auch am Universitätsklinikum Tübingen im klinischen Forschungslabor der Kinderherzchirurgie, bringt dort seine Expertise mit dem neuen in-vitro-Pyrogentest ein und entwickelt sie weiter.
von links nach rechts: Prof. Dr. Hans Peter Wendel, Prof. Dr. Albrecht Wendel, Dr. Stefan Fennrich
Foto: Wendel
Das Triumvirat Professor Dr. Albrecht Wendel (ICEPHA, UKT), Professor Dr. Hans Peter Wendel und Dr. Stefan Fennrich haben aktuell die Auszeichnung „Ausgewählter Ort 2011“ durch die Initiative „Deutschland - Land der Ideen“ für das Thema „PyroDetect - Innovatives Medikamententestverfahren“ erhalten. Die Arbeitsgruppe darf sich nun „Ausgewählter Ort 2011“ nennen. Nähere Informationen unter: http://www.land-der-ideen.de/
Die Arbeitsgruppen „Hämokompatibilität“ und „Pyrogentest“
Das Forschungslabor Kinderherzchirurgie am Universitätsklinikum Tübingen umfasst fünf Arbeitsgruppen. Professor Dr. Hans Peter Wendel ist Leiter des Forschungslabors, in dem zwischen 20 und 25 Mitarbeiter arbeiten. Sie beschäftigen sich u. a. mit der Lösung von Fragen, die bei blutkontaktierenden Systemen (z. B. Implantate, Komponenten der Herz-Lungen-Maschine, Kunstherzmodelle, Stents, künstliche Blutgefäße) im Bereich der Herz- und Gefäßchirurgie auftreten. Im Fokus stehen aber auch andere Fragestellungen, wie z. B. Wundheilungsstörungen. Ein weiterer Ansatz ist auch die Selbstbesiedlung von Transplantaten durch Patienten-eigene Endothelzellen mit dem Ziel, dass das neue Organ physiologisch mit dem Organismus (Kind) mitwachsen kann, ohne schädliche Gewebeveränderungen auszulösen. Die Arbeiten in der Forschungsgruppe umfassen frühe Phasen der Grundlagenforschung und reichen bis zur präklinischen (anwendungsorientierten) Forschung. Eine Vision ist es z. B., Menschen mit Bypass-Operationen, die dazu heute aus ihrem eigenen Körper ein venöses Blutgefäß brauchen, mit selbstbesiedelnden Gefäßprothesen auszustatten. Die Anwendung von Oxigenatoren der Herz-Lungen-Maschinen, der Einsatz von Herzunterstützungssystemen oder auch die Blutwäsche können Blutabwehrreaktionen des Körpers hervorrufen. Es werden Untersuchungs- und Anwendungsmethoden entwickelt, die der Verbesserung der Blutverträglichkeit der eingesetzten Materialien dienen. Hierbei ist die Kompetenz, in vitro Blut als „Sensor“ einzusetzen von besonderer Bedeutung, sowohl im Bereich der Hämokompatibilität als auch der Pyrogenität. Es sind hervorragende humanrelevante Modelle, da es um die Anwendung an Menschen und deren Sicherheit geht.
Interessant und wichtig ist auch die Forschung an Aptameren. Das sind künstlich hergestellte kurze DNA-Stücke (Länge von 25 bis 70 Basenpaaren), die sich aufgrund ihrer dreidimensionalen Struktur ähnlich den Antikörpern fest an bestimmte Oberflächenstrukturen binden können. Mit ihnen sollen „Fängermoleküle“ hergestellt werden, die in der Lage sind, blutbildende Stammzellen aus der Umgebung (Blutkörperchen entstehen aus Stammzellen des Knochenmarks) herauszufischen. Mit diesen Aptameren können Trägermaterialien von Gefäßprothesen beschichtet werden, um so eine Selbst- und Neubesiedlung mit körpereigenen Blutgefäßzellen zu erreichen.
Das Tübinger Labor hat mit seiner Expertise eine Akkreditierung nach GLP (Good Laboratory Practices) für die Prüfung von blutkontaktierenden Medizinprodukten gemäß DIN EN ISO 10993-4 erhalten – der weltweit höchste Laborstandard.
Dr. med. Stefan Fennrich leitete von 1997 bis 2005 die Entwicklungsgruppe am Konstanzer Lehrstuhl Biochemische Pharmakologie von Prof. Dr. Albrecht Wendel. Inzwischen ist er Studien- und Projektleiter im Forschungslabor der Kinderherzchirurgie von Professor Dr. Hans Peter Wendel am Universitätsklinikum Tübingen. Er hatte bereits mit seiner früheren Arbeitsgruppe „in-vitro Pyrogentest“ zahlreiche Auszeichnungen erhalten, aktuell in der Tübinger Gruppe zusammen mit Professor Dr. Albrecht Wendel und Professor Dr. Hans Peter Wendel in dem Wettbewerb "365 Orte im Land der Ideen" für das Thema „PyroDetect – Innovatives Medikamententestverfahren“ die Auszeichung „Ausgewählter Ort 2011“ in der Initiative „Deutschland – Land der Ideen“.
Im klinischen Forschungslabor legen die Wissenschaftler Wert auf die Verwendung humanrelevanter Verfahren, die eine humanspezifische Bewertung von Forschungsergebnissen zulassen. Daher wird nach Möglichkeit auf Tierversuche verzichtet und werden in-vitro-Verfahren bevorzugt.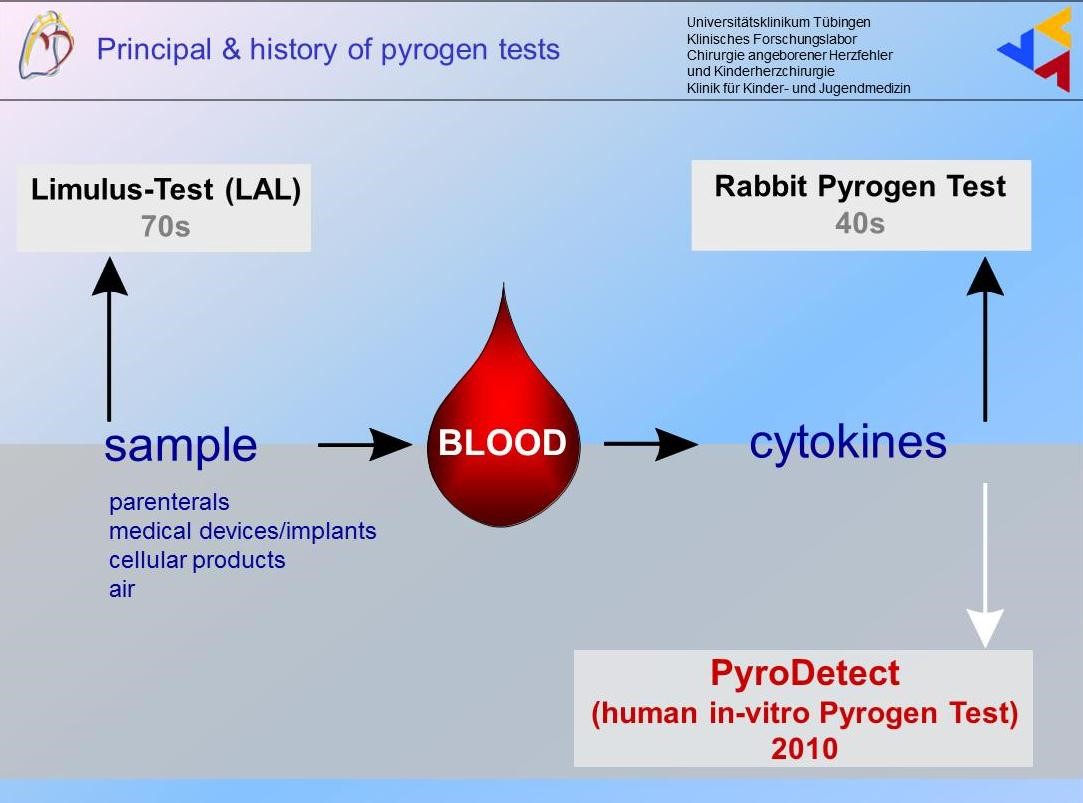
Entwicklung des PyroDetect und Prinzip
Grafik: Stefan Fennrich
Das PyroDetect-System nutzt eine angeborene menschliche Immunreaktion auf sogenannte Pyrogene, bakterielle Substanzen wie z. B. Zellwandfragmente, Partikel von Hefen, Pilzen oder Viren. Als Fremdkörper lösen sie eine Abwehrreaktion im Körper aus, was mit einer Fieberreaktion verbunden ist.
Für den Test wird humanes Vollblut verwendet, dessen weißer Blutzelltyp Monozyt / Makrophage als Reaktion auf Pyrogene bestimmte Glykoproteine, die Zytokine, ausschüttet. Eines dieser proinflammatorischen (entzündungserregenden) Zytokine ist das Interleukin 1ß, IL-1ß genannt. Es ist im menschlichen Körper in geringsten Mengen vorhanden und nicht nachweisbar. Im in-vitro-Verfahren ist IL-1ß als Nachweis von pyrogenen Reaktionen bestens geeignet.
Die Testlösung/Probe wird mit dem Blut in Kontakt gebracht und im Brutschrank bei 37°C (Körpertemperatur) inkubiert. Sind Pyrogene vorhanden, wird von den Monozyten/Makrophagen IL 1ß im Blut gebildet. An das IL-1ß wird nun im sogenannten ELISA-Verfahren ein Antikörper gebunden, der mit Hilfe einer Farbreaktion sichtbar gemacht werden kann. Die pyrogene Kontamination kann nun bestimmt werden.
Das PyroDetect-System weist ein vergleichbar umfassendes Pyrogen-Spektrum wie der Kaninchentest und ein wesentlich breiteres als der Limulus-Amöbozyten-Lysat (LAL)-Test nach, mit dem sich eingeschränkt nur Lipopolysaccharide Gram-negativer Bakterien (Endotoxine) nachweisen lassen.
Einfache Handhabung des PyroDetect:
(1) Kryoblutentnahme für die Vollblutinkubation,
(2) Mischen des Kryoblutes mit der zu untersuchenden Probe, anschließend Inkubation bei 37°C für ca. 18 Stunden (der Fiebersignalstoff Interleukin-1ß wird ausgeschüttet bei Anwesenheit von Pyrogenen),
(3) Nach der Inkubation wird der Probenansatz in einer mit Antikörper beschichteten Mikrotiterplatte überführt. Antikörper binden an vorhandenes Interleuking-1ß, welches mit einem Substrat zu einer blauen Farbe reagiert (hellblau wenig, dunkelblau viel Interleukin-1ß). Die Farbreaktion wird nach einigen Minuten gestoppt, die Farbe blau verwandelt sich in gelb (hellgelb wenig, dunkelgelb viel Interleukin-1ß),
(4) Die Intensität des Gelbtones wird photometrisch in einem ELISA-Reader gemessen.
Fotonachweise: Biotest AG
Flächendeckende Anwendung des PyroDetect
InVitroJobs befragte Dr. Stefan Fennrich nach dem gegenwärtigen Stand der Forschungsarbeiten, den Schwierigkeiten bei der Anerkennung ihrer Ersatzmethode zum Tierversuch und den Aussichten und Perspektiven für die Forschungsarbeiten.
InVitroJobs: Herr Dr. Fennrich: Nachdem der PyroDetect entwickelt war, wie verlief das Prozedere bis zur Anerkennung?
Dr. Stefan Fennrich: Der in-vitro-Pyrogentest (PyroDetect) erlebte von der Idee bis zur erfolgreichen Anerkennung viele Stationen: Seine Idee stammt aus der Universität Konstanz, dem Lehrstuhl für Biochemische Pharmakologie von Professor Dr. Albrecht Wendel, dort wurde er entwickelt und fit gemacht für die Validierung, und erste neue Anwendungsgebiete wurden untersucht. Der internationalen Validierung, die auch Varianten der in-vitro-Methode beinhaltete, schloss sich eine Phase der Begutachtung der Validierungsergebnisse durch ein Expertengremium an. Als dieses positiv abgeschlossen werden konnte, wurde von einer internationalen Expertenkommission die Implementierung in die Regularien ausgearbeitet. Diese Implementierung wurde umgesetzt und findet sich seit 2010 in der Europäischen Pharmakopöe 6.7, Kapitel 2.6.30 unter dem Namen Monozyten-Aktivierungstest MAT.
InVitroJobs: Wie läuft der Validierungsprozess ab und wie lange hat er gedauert?
Dr. Stefan Fennrich: Der eigentliche Validierungsprozess lief europaweit über mehrere Jahre und wurde vom Europäischen Zentrum für die Validierung von Alternativmethoden (ECVAM: European Centre for the Validation of Alternative Methods) durchgeführt. Basierend auf dem Verständnis der menschlichen Fieberreaktion wurden Varianten von in-vitro-Methoden validiert, bei denen Monozyten/Makrophagen durch Pyrogene aktiviert werden. Somit wurden in einer Blindstudie mit prototypischen Parenteralia (injizierbare Arzneimittel) sechs Testvarianten in zehn Labors validiert. Vier von diesen Testvarianten erzielten die Kriterien für die Detektion von Pyrogenen und stellen somit eine Alternative zum Kaninchenpyrogentest dar.
InVitroJobs: Da der Test jetzt in der Pharmakopoe vorgeschrieben ist: wird er auch außerhalb Europas angewandt bzw. befindet er sich in amerikanischen oder anderen Vorschriften?
Dr. Stefan Fennrich: Unabhängig von der Regulierung der Methode in der Pharmakopoe kann die in-vitro-Methodik auch in nicht regulierten Bereichen eingesetzt werden. Das betrifft zum Beispiel viele Entwicklungs- und Forschungsprojekte oder auch Prozesskontrollen, bei denen die Pyrogenfreiheit eine bedeutende Rolle spielt. Die amerikanischen Behörden waren von Anfang an in den Validierungsprozess eingebunden und befürworten eine produktspezifische Validierung mit der in-vitro-Methodik. Der Prozess der Implementierung in die ISO-Norm ist bereits initiiert, dies betrifft z. B. die Prüfung von Medizinprodukten (Implantaten) (ISO/TC 194/WG 16 Working group Pyrogenicity, biological assessment of medical devices).
InVitroJobs: Gibt es in Ihrer Arbeitsgruppe noch weitere Entwicklungen zum Ersatz von Tierversuchen?
Dr. Stefan Fennrich: Die Prüfung auf Hämokompatiblilität von Medizinprodukten bieten wir als in-vitro-Methode gemäß ISO 10993-4 an und sind dafür GLP (siehe Glossar) zertifiziert. Wir verwenden auch hier den „Sensor Blut“ in vitro, sowohl in statischen als auch in dynamischen Flussmodellen und am Modell der Herz-Lungen-Maschine.
InVitroJobs: Der PyroDetect soll auf "andere Anwendungsgebiete" übertragen werden: auf welche?
Dr. Stefan Fennrich: Der in-vitro-Pyrogentest (PyroDetect) hat sich als geeignet erwiesen, sowohl flüssige Proben (Parenteralia) zu testen, als auch in direktem Kontakt Oberflächen auf pyrogene Aktivität zu untersuchen (Beispiel: Implantate) und auch zelluläre Therapeutika zu testen. Aus dem Bereich der Arbeitsmedizin nimmt die Luftqualität eine wichtige Stellung ein. Beispiele sind hier die Landwirtschaft, industrielle Fertigungsprozesse, Biotechnologie und alle mit raumlufttechnischen Anlagen ausgestatteten Einrichtungen.
InVitroJobs: Wie ist hier der Entwicklungsstand?
Dr. Stefan Fennrich: Sowohl für Oberflächenprüfungen an Modellen von Implantaten als auch für die Prüfung von Luftkontaminationen wurden erfolgreiche Machbarkeitsstudien durchgeführt, die auch jeweils publiziert sind.
Aktuell arbeiten wir an Modellen, mit denen wir humanspezifisch mit dem PyroDetect die gesundheitliche Belastung von Luftkontaminationen an industriellen Arbeitsplätzen beurteilen können. Durch unmittelbare Kooperation mit Berufsgenossenschaften und der Arbeitsmedizin entwickeln wir Prozesse, die sowohl für Behörden als auch Gesetzgeber im Sinne von Arbeitsschutz und Prävention Bedeutung haben.
Die Prüfung auf Luftqualität ist für Berufsgenossenschaften ein wichtiges Thema, da an vielen Arbeitsplätzen Luft eingeatmet wird, die mit unterschiedlichen Kontaminationen versetzt sein kann. Offensichtlich ist das in landwirtschaftlichen Betrieben, aber auch die metallverarbeitende Industrie kennt diese Fragestellungen. Z. B. können eingesetzte Kühl-Schmierstoffe als Aerosol in die Atemluft gelangen. Wir entwickeln aktuell Technologien und Verfahren, um solche Luftkontaminationen humanspezifisch prüfen und bewerten zu können.
InVitroJobs: Welche Schwierigkeiten ergeben sich bei der Entwicklung?
Dr. Stefan Fennrich: Wir bewegen uns in neue Anwendungsgebiete hinein, somit ist die Herausforderung, uns mit neuen Technologien und Fragestellungen auseinanderzusetzen. Wir sind in einem täglichen Lernprozess, bei dem interdisziplinäres Denken die tägliche Arbeit bestimmt. Das betrifft sowohl die Zusammenarbeit verschiedener wissenschaftlicher Disziplinen als auch, die Forschung und Entwicklung in industrielle und anwendungsbezogene Verfahren und Produkte umzusetzen.
InVitroJobs: Werden Sie für Ihre Projektarbeiten ausreichend unterstützt? Wie ist die Situation auf dem „Forschungsgeldermarkt“?
Dr. Stefan Fennrich: Die Forschung und Entwicklung wird mit Geldern durch Drittmittelprojekte oder Mittel durch die Industrie während gemeinsamer Forschungsarbeiten finanziert. Die Mittel sind begrenzt und wünschenswert wäre ein finanzieller Rückhalt, mit dem wegweisende Projektideen in Pilotstudien auf Machbarkeit untersucht werden und bestehende Konzepte weiterentwickelt werden können. Ein wichtiges Projekt ist z. B. die Implementierung des PyroDetect unter der Qualität des GMP-Standards, weil erst dadurch erfolgreich dies Verfahren als Ersatz zum Kaninchentest angeboten und umgesetzt werden kann. Genau das haben wir aktuell vor, denn mein Anliegen ist es, flächendeckend die in-vitro-Methode zur Vermeidung unnötiger Tierversuche anbieten zu können. Das heißt, überall, wo die Pyrogentests an Kaninchen noch vorgeschrieben sind bzw. durchgeführt werden, diese verpflichtend durch den PyroDetect zu ersetzen und dort, wo in anderen Versuchen Versuchstiere eingesetzt werden, den Tierverbrauch durch in-vitro-Verfahren zu reduzieren oder auch zu ersetzen.
Um Forschungsgelder zu erhalten, ist ein entsprechender Antrag für ein Forschungsprojekt notwendig, der begutachtet wird und dann erst mit einer bestimmten Wahrscheinlichkeit bewilligt werden kann. Solche Anträge sind aufwändig und die Bewilligung der Mittel nicht vorauszusehen. Zur Antragstellung gehört z. B. auch die Initiierung von Verbundprojekten, da es sich in meiner Situation oft um interdisziplinäre Projekte handelt, bei denen ich Kooperationspartner mit ihrer spezifischen Expertise benötige. Es ist eine tägliche Herausforderung, denn auch die Mitarbeiterinnen und Mitarbeiter in meiner Arbeitsgruppe müssen auf diese Weise finanziert werden. Personalkontinuität ist für mich ein wichtiges Anliegen, denn das fließt unmittelbar in den Projekterfolg ein. Desgleichen sind Zulassungsarbeiten (Bachelor, Master Thesis, Diplom, Doktorarbeiten) wichtige Pfeiler für Forschungsprojekte.
InVitroJobs: Wie ist die Motivation bei jungen Studenten/Absolventen, sind sie interessiert an Ersatzverfahren?
Dr. Stefan Fennrich: Grundsätzlich beobachte ich eine hohe Motivation bei jungen Studenten/Absolventen, in Bereichen der Ersatzmethodenentwicklung zu arbeiten. Ich kläre z. B. in meinen Vorlesungen über die Mitarbeit bei uns auf, bisher fanden sich immer Interessenten für Abschlussarbeiten.
InVitroJobs: Wie sind die Ausbildungsvoraussetzungen der Absolventen /Jungwissen-schaftler, muss mehr für die Lehre im Bereich der Ersatzverfahren getan werden?
Dr. Stefan Fennrich: Ich glaube, dass sehr viel Forschung und Entwicklung geleistet wird, ohne dass das Potenzial der Ersatzmethode benannt oder sogar erkannt wird. Dies zu benennen und in die Lehre einzubeziehen halte ich für eine gute Chance, für das Thema vertiefend zu sensibilisieren und das Mitdenken anzuregen.
InVitroJobs: Wie schätzen Sie die derzeitige Leistungsfähigkeit von Ersatzverfahren ein?
Dr. Stefan Fennrich: Grundsätzlich steht eine in-vitro-Methode in Konkurrenz zu in-vivo-Verfahren, besonders wenn es sich um gesetzlich regulierte Versuche handelt. Historisch werden in-vivo-Verfahren zu sogenannten „goldenen Standards“, mit denen sich die Ersatzmethoden messen müssen, egal wie mangelhaft dieser Standard sein mag. Für den PyroDetect als in-vitro-Pyrogentest besteht die historische Chance, den Kaninchentest in absehbarer Zeit konsequent zu ersetzen - damit wurde dann Geschichte in der Arzneimittelsicherheit und im Tierschutz geschrieben.
InVitroJobs: Was bedeutet es Ihrer Meinung nach für die Finanzierung von Ersatzmethoden, wenn die Grenzen zwischen Grundlagen und angewandter Forschung mittlerweile gar nicht mehr existieren?
Dr. Stefan Fennrich: Wir sollten nicht in Grenzen denken und Claims abstecken! Grundlagenforschung ist notwendig und wird früher oder später in Anwendungen münden. Jeder Erfolg beginnt mit dem ersten Schritt, egal wie klein er ist oder wie lang der Weg ist. Wenn also Grenzen zwischen Grundlagen und angewandter Forschung zunehmend verschwinden bedeutet es auch, dass erfolgreiche angewandte Entwicklungen, wie es die Ersatzmethoden sind, immer wahrscheinlicher werden. Ersatzmethoden sollten großzügig finanziert werden.
InVitroJobs: Wir danken für dieses Gespräch.
Glossar:
Hämostase
Blustillung und Blugerinnung.
GMP
Unter GMP (Good Manufacturing Practice, Gute Herstellungspraxis) versteht man Richtlinien zur Qualitätssicherung der Produktionsabläufe und -umgebung in der Produktion von Arzneimitteln und Wirkstoffen, aber auch bei Lebens- und Futtermitteln. In der pharmazeutischen Herstellung spielt die Qualitätssicherung eine zentrale Rolle, da hier Qualitätsabweichungen direkte Auswirkungen auf die Gesundheit der Verbraucher haben können. Ein GMP-gerechtes Qualitätsmanagementsystem dient der Gewährleistung der Produktqualität und der Erfüllung der für die Vermarktung verbindlichen Anforderungen der Gesundheitsbehörden (Unbedenklichkeit).
GLP
GLP ist ein Qualitätssystem, das den organisatorischen Ablauf von Prüfungen, die Rahmenbedingungen, unter denen diese geplant, durchgeführt und überwacht werden, sowie die Aufzeichnung, Berichterstattung und Archivierung dieser Prüfungen umfasst. GLP wird für die Untersuchungen Toxizität, Ökotoxizität, Mutagenität, Umweltverhalten und Bioakkumulation, Rückstände, Auswirkungen auf Mesokosmen und natürliche Ökosysteme, physikalisch-chemische Eigenschaften, analytisch-chemische Eigenschaften und weitere genau zu beschreibende Eigenschaften gefordert.
GLP wurde zuerst 1978 für Tierversuche, welche für die Zulassung von Arzneimitteln zwingend notwendig sind, in den USA eingeführt. Heute sind die GLP Richtlinien weltweit vorgeschrieben und müssen u. a. mindestens bei den Untersuchungen zur Zulassung von Arzneimitteln, Medical Devices, Industrie- und Agrochemikalien angewandt werden.
GLP-Zertifizierung
Wenn in einem Labor alle nach GLP geforderten Elemente integriert sind und auch angewandt werden, kann es zertifiziert werden. Es erscheint auf der Liste der GLP-Laboratorien, welche innerhalb des Landes und der OECD veröffentlicht wird.
Limulus-Amöbozyten-Lysat-Test (LAL-Test)
In den 1970er-Jahren wurde ein erster in vitro-Test zum Nachweis von Endotoxinen und hitzestabilen Zellwandbestandteilen gram-negativer Bakterien sowie Blaualgen entwickelt. Der Test beruht auf der Beobachtung, dass eine Infektion des Pfeilschwanzkrebses (Limulus polyphemus) mit gram-negativen Bakterien zu einer Blutgerinnung führt. Diese resultiert aus einer Reaktion des bakteriellen Endotoxins mit einem Gel bildenden Protein in den Blutzellen (Amoebozyten) des Tieres. Für den LAL-Test wird aus dem blauen Blut der Pfeilschwanzkrebse ein Lysat gewonnen, in dem das Gel bildende Protein als inaktive Vorstufe (inaktives Proenzym) vorliegt. Die Zugabe von Endotoxin führt zur Umwandlung der inaktiven Vorstufe in das aktive Enzym. Das aktive Enzym reagiert mit einem zugegebenen synthetischen Substrat (Peptid), das zunächst farblos ist und nun eine gelbeFärbung annimmt. Es wird eine indirekte photometrische Bestimmung der Enzymaktivität vorgenommen.
Vom ethischen Standpunkt aus betrachtet ist der LAL-Test kritisch zu beurteilen. In den Vereinigten Staaten z. B. sterben pro Jahr 30 000 Tiere für den Test. Durch Einnahme aus der Natur kommt es zu einen Rückgang der natürlichen Population und zu einem Ungleichgewicht im Ökosystem seines natürlichen Lebensraum.
Quellen:
http://www.analytik-news.de/Links/Qualitaetssicherung/GMP.html
http://www.qac.ch/GLP_Zertifizierung.htm
http://www.bma-labor.de/pages/endotoxine.html
Bachinski, R. et al. (2010): Criticism of the LimulusAmoebocyte Lysate (LAL) test as an replacement method of the rabbit pyrogen test (RPT) and environmental health implicyations. Altex Abstractband ESTIV - EUSAAT- Tagung Linz 2010.
siehe auch zu 3R-Prinzipien:
http://www.forschung3r.ch/data/news/press_supplement_20th_anniversary_d.pdf




 Dr. rer. nat.
Dr. rer. nat. Menschen für Tierrechte - Tierversuchsgegner Rheinland-Pfalz e.V.
Menschen für Tierrechte - Tierversuchsgegner Rheinland-Pfalz e.V.